Liderado por brasileiros, grupo descobre mecanismo causador da síndrome de Pitt-Hopkins, disfunção neuropsiquiátrica com características de TEA
Um grupo liderado pelo cofundador da Tismoo Biotech, o neurocientista brasileiro Dr. Alysson R. Muotri, da Universidade da Califórnia San Diego, nos Estados Unidos, em parceria com cientistas brasileiros da Universidade Estadual de Campinas (Unicamp), conseguiu reverter a evolução da síndrome de Pitt-Hopkins em modelos humanos de laboratório, além de descobrir o mecanismo causador dessa condição de saúde. A descoberta abre caminho para a possibilidade de tratamento tanto com medicamento como terapia gênica para a síndrome, que é um dos subtipos de Transtorno do Espectro do Autismo (TEA).
O trabalho científico foi publicado nesta segunda-feira, 2.mai.2022, na revista Nature Communications. “A terapia genética nunca foi testada para o autismo. Já imaginou reverter de vez todos os sintomas indesejados e comorbidades do autismo profundo? Nosso trabalho com a síndrome de Pitt-Hopkins é a porta de entrada para a melhores condições de vida e aumento do potencial de indivíduos autistas”, explicou Muotri.
Outro coordenador do trabalho, ao lado de Muotri, foi Fabio Papes, professor do Instituto de Biologia (IB-Unicamp): “Para a maioria dos casos de TEA, não se sabe qual gene causa a condição quando mutado. Assim é também para a maioria das doenças neuropsiquiátricas, como esquizofrenia, depressão e transtorno bipolar. A síndrome de Pitt-Hopkins, por sua vez, tem como origem uma mutação no gene TCF4. Mas, até então, não eram conhecidos seus mecanismos moleculares, ou seja, o que há de diferente nas células do sistema nervoso dos pacientes com a mutação”, contou Papes.
A pesquisa — que teve apoio, no Brasil, da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) e do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq); e, nos EUA, do National Institutes of Health (NIH) e da Pitt-Hopkins Research Foundation (PHRF) — agora deve avançar para estudos pré-clínicos e clínicos. Os pesquisadores fecharam parceria com uma empresa especializada em terapia gênica, que está licenciando a tecnologia usada nos experimentos para que futuramente possa ser testada em humanos.
Síndrome de Pitt-Hopkins
Caracterizada por déficit cognitivo, atraso motor profundo, ausência de fala funcional e anormalidades respiratórias, entre outros, a síndrome de Pitt-Hopkins foi descrita em 1978, mas seu gene causador — chamado TCF4 — ficou conhecido apenas em 2007. A estimativa é de que a prevalência seja de 1 a cada 35 mil nascimentos.
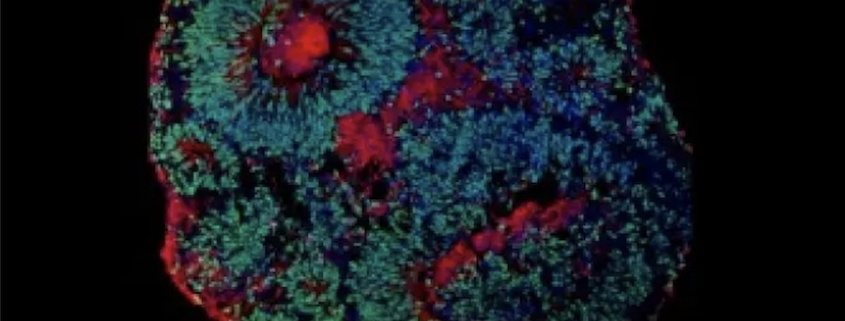
Para esta pesquisa foram usados organoides cerebrais humanos (também conhecidos como minicérebros, estruturas desenvolvidas a partir de células-tronco reprogramadas dos próprios indivíduos) — tanto dos pacientes com a síndrome, como de seus pais —, já que a síndrome não se desenvolve em camundongos da mesma maneira que em seres humanos. Os minicérebros dos pais se desenvolveram normalmente; os das pessoas com a mutação no TCF4 cresciam menos — resultado da menor replicação das células causada pela síndrome e de um prejuízo da própria neurogênese —, além de terem neurônios em menor número e com menor atividade elétrica comparados aos dos pais, que eram os minicérebro de controle. Essa descoberta pode explicar muitas características clínicas desses pacientes.
São resultados semelhantes aos obtidos no primeiro estudo do cérebro de uma pessoa com síndrome de Pitt-Hopkins, quando foram analisados os tecidos post-mortem (de um paciente falecido por outras razões), o que reforça as conclusões obtidas com os minicérebros. “O acesso ao cérebro post-mortem foi essencial para validarmos alguns dos resultados obtidos com os organoides cerebrais. O fato de termos visto características semelhantes entre o organoide criado em laboratório e o cérebro mostra o quão relevante é essa tecnologia”, afirma Muotri.
Terapia gênica
Após desvendar quais alterações foram causadas pela mutação no gene TCF4, os pesquisadores buscaram maneiras de corrigi-la e, assim, realizar uma prova de conceito do que seria um possível tratamento.
Foram testadas três maneiras diferentes estratégias:
 A primeira foi utilizando a técnica de manipulação gênica conhecida como CRISPR-Cas9. Nesse contexto, uma versão recente da técnica foi empregada para fazer com que a cópia funcional do gene existente na célula disfuncional passe a expressar muito mais proteína, compensando a cópia afetada pela mutação causadora da síndrome de Pitt-Hopkins.
A primeira foi utilizando a técnica de manipulação gênica conhecida como CRISPR-Cas9. Nesse contexto, uma versão recente da técnica foi empregada para fazer com que a cópia funcional do gene existente na célula disfuncional passe a expressar muito mais proteína, compensando a cópia afetada pela mutação causadora da síndrome de Pitt-Hopkins.
A segunda intervenção, usando uma técnica diferente, os cientistas inseriram uma cópia extra do gene, que passou a exercer normalmente as funções gênicas, compensando a cópia mutada.
“Nosso genoma tem duas cópias de cada gene. O que causa a síndrome de Pitt-Hopkins é o fato de uma das cópias do TCF4 não funcionar. Inserir uma terceira cópia ou fazer com que a única cópia funcional expresse mais proteína para compensar a defeituosa pode solucionar o problema”, diz o pesquisador.
Os organoides que sofreram as intervenções passaram a crescer normalmente e tiveram um aumento da proliferação das células progenitoras, que no cérebro dão origem a diferentes tipos de célula, inclusive neurônios.
“Ainda que esse distúrbio seja considerado raro, existem outros que envolvem mutações nesse mesmo gene. Portanto, o que descobrimos aqui pode, futuramente, ser aplicado para transtornos como a esquizofrenia, por exemplo”, afirma Papes.
Fármaco
Uma terceira estratégia foi a aplicação de uma droga usada em estudos com células tumorais. Conhecida pela sigla CHIR99021, ela ativa uma via de sinalização celular conhecida como Wnt, muito estudada no contexto do câncer e que os autores descobriram ser alterada também por mutações no gene TCF4.
Em células e organoides disfuncionais tratados com a droga houve melhora em alguns indicadores moleculares e aumento de tamanho (no caso dos organoides). Os resultados abrem caminho para o desenvolvimento de medicamentos similares que possam tratar a disfunção, uma vez que a CHIR99021 ainda não pode ser utilizada em seres humanos.
“Essa via tratada com a droga é apenas uma das alteradas pela mutação no gene TCF4. A vantagem de uma terapia gênica em relação a um tratamento farmacológico é que ela resolveria o problema na sua origem. No entanto, a busca por novas drogas também é promissora”, diz Papes.
O estudo original completo pode ser acessado no site da Nature, em: nature.com/articles/s41467-022-29942-w.

 Muotri Lab
Muotri Lab
