Liderado pelo SickKids, o estudo sequenciou os genomas completos de mais de 20 mil indivíduos, sendo o maior do mundo até hoje
Pesquisadores do Hospital for Sick Children (SickKids), do Canadá, descobriram novos genes e alterações genéticas associadas ao transtorno do espectro do autismo (TEA) na maior análise de sequenciamento do genoma do autismo até o momento, fornecendo uma melhor compreensão da ‘arquitetura genômica’ por trás desse transtorno. Ao todo, eles fizeram uma lista com 134 genes como sendo os principais ligados ao TEA.
O estudo, publicado na revista Cell, no último dia 10.nov.2022, avaliou o sequenciamento do genoma completo (WGS, na sigla em inglês) de mais de 7.000 indivíduos com autismo, bem como outros mais de 13.000 irmãos e familiares que não estão no espectro do autismo. A equipe encontrou 134 genes ligados ao TEA e descobriu uma série de alterações genéticas, principalmente variações do número de cópias dos genes (CNVs, na sigla em inglês), provavelmente associadas ao autismo, incluindo variantes raras associadas ao TEA em cerca de 14% dos participantes com autismo. Vale destacar, porém, que há atualmente 1.097 genes (nov.2022), entre uma variedade com mais e com menos importância, sendo estudados com alguma relação com autismo, segundo o Sfari Gene — um dos mais respeitados bancos de dados do mundo sobre genética do autismo.
Variabilidade fenotípica
“Esse trabalho demonstra, agora com mais dados, e com poder estatístico, que a variabilidade fenotípica dentro do espectro do autismo é condizente com a grande variabilidade de alterações estruturais e genéticas do DNA dessa população com TEA. Porém, mais estudos são necessários para investigar de forma mais profunda cada categoria de alteração genética, de forma que consigamos estratificar de forma mais clara cada tipo de TEA com base no fenótipo e genótipo deles.”, avaliou o bioinformata Dr. Roberto Herai, um dos fundadores da Tismoo.
Para Dra. Graciela Pignatari, bióloga com doutorado em biologia molecular, “esse estudo mostra a importância de se entender cada dia mais sobre a genética do autismo, a relevância do sequenciamento do genoma completo e de como podemos ter diferentes tipos de alterações genéticas sendo importantes para o TEA. Nesse estudo foram encontradas aliterações estruturais como alterações de ponto em regiões codificadoras e não codificadoras. Por fim, novos genes e alterações sendo conhecidas afirmam a importância da reanálise de dados” explicou a bióloga, que também é uma das fundadoras, além de responsável técnica da Tismoo Biotech.
A maioria dos dados foi extraída do banco de dados Autism Speaks MSSNG , o maior conjunto de dados de genoma completo de autismo do mundo, que fornece aos pesquisadores de autismo acesso livre e aberto a milhares de genomas sequenciados, mas também foram usados dados do Simons Simplex Collection (SSC) e do projeto 1000 Genomas (1000G).
“Ao sequenciar todo o genoma de todos os participantes e com profundo envolvimento das famílias participantes do MSSNG na formação de nossas prioridades de pesquisa, maximizamos o potencial de descoberta e permitimos análises que englobam todos os tipos de variantes, desde as menores alterações de DNA até aquelas que afetam cromossomos inteiros”, disse o Dr. Stephen Scherer , cientista sênior do programa de Genética e Biologia do Genoma e chefe de pesquisa do SickKids Hospital, além de diretor do Centro McLaughlin da Universidade de Toronto, na divulgação do estudo.
‘Família multiplex’
O artigo também aponta nuances importantes na genética do autismo em famílias com apenas um indivíduo com autismo em comparação com famílias que têm vários indivíduos com autismo, conhecidas como “famílias multiplex”. Surpreendente para a equipe foi que a “pontuação poligênica” – uma estimativa da probabilidade de um indivíduo ter autismo, calculada pela agregação dos efeitos de milhares de variantes comuns em todo o genoma – não foi maior entre as famílias multiplex.
“Isso sugere que o autismo em famílias multiplex pode ser mais provável de estar ligado a variantes raras e altamente impactantes herdadas de um dos pais. Como os traços genéticos e clínicos associados ao autismo são tão complexos e variados, grandes conjuntos de dados como os que usamos são essenciais para fornecer aos pesquisadores uma compreensão mais clara da arquitetura genética do autismo”, disse, no evento de divulgação do paper, Brett Trost, pesquisador que é o autor principal do estudo.
O estudo completo pode ser lido neste link.

 Depositphotos / Revista Autismo
Depositphotos / Revista Autismo
 Spectrum 10k
Spectrum 10k illustration by Laurène Boglio / Spectrum News
illustration by Laurène Boglio / Spectrum News
 divulgação / Tismoo
divulgação / Tismoo
 montagem com fotos do Instagram
montagem com fotos do Instagram
 Tismoo
Tismoo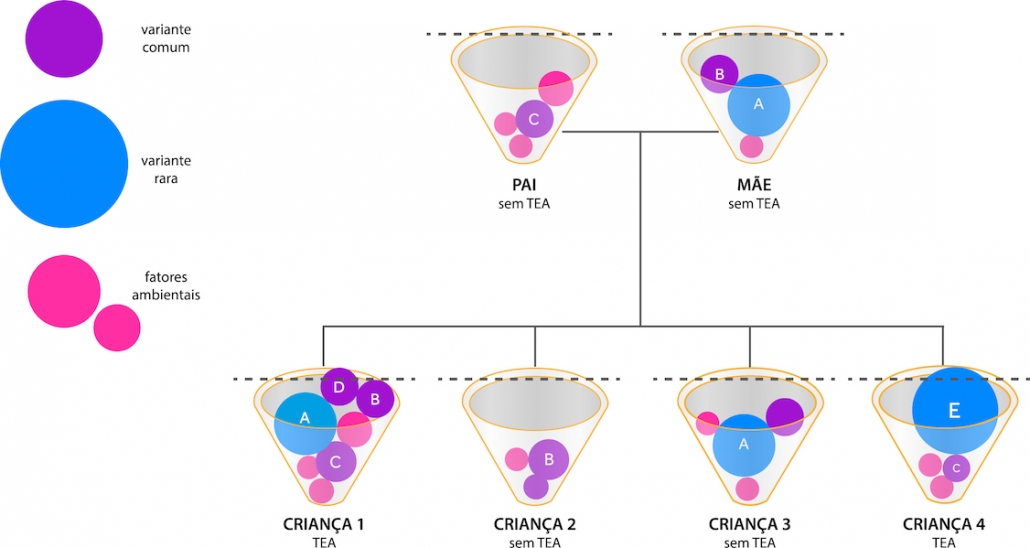
 Superinteressante / divulgação
Superinteressante / divulgação
 Revista Autismo
Revista Autismo
